蝙蝠为什么不会得癌症?它拥有高活性 p53和无尽端粒
在大自然的长寿排行榜上,蝙蝠是一个让科学家们百思不得其解的黑马。它们的身体小得可以藏进巴掌里,心跳动辄上千次每分钟,却能活上三十多年。按照哺乳动物的一般规律,这样的高代谢、高氧消耗的小型动物,本该寿命短暂、易于衰老,甚至更容易患上癌症。但现实完全相反:蝙蝠不仅活得久,而且几乎不患癌症。

蝙蝠为什么会长寿(图片来源:作者使用AI生成)
在多项野生与圈养蝙蝠的观察研究中,肿瘤的发病率几乎可以忽略不计。为什么蝙蝠能打破“活得越久越容易得癌”的生物学定律?最新一项由罗切斯特大学的研究,或许给出了答案,蝙蝠细胞其实并不难被癌变引诱,但它们的身体却拥有更强大的清除机制,一旦细胞出现异常,能比我们快得多地启动自毁程序,或者让免疫系统精准猎杀。这项研究不仅揭示了蝙蝠抵御癌症的奥秘,也可能为人类抗癌策略带来全新启发。
从细胞开始:蝙蝠并不“天生不怕癌”
我们常以为,长寿动物若能避免癌症,关键就在于它们的细胞更坚不可摧。比如裸鼹鼠、象和鲸这些已知的抗癌高手,它们的细胞普遍对肿瘤形成有天然的强抗性,要想让这些细胞发生癌变,得经历好几道“关卡”。
那么蝙蝠的细胞是不是也同样牢固呢?答案出人意料。来自罗切斯特大学的研究团队选取了四种寿命较长的蝙蝠物种,包括著名的“小褐蝙蝠”(Myotis lucifugus),在实验室中对它们的成纤维细胞进行转化实验——这是一种模拟肿瘤形成的体外模型。
结果显示,仅仅两步就足以让蝙蝠细胞产生类似癌细胞的特征,第一步,关闭关键的抑癌机制,如p53 或pRb 通路。第二步,激活如 Ras 这样的致癌信号通路。更惊人的是,这个易变程度,和实验小鼠几乎一样。相比之下,人类细胞需要经历多达五个以上的基因通路变化,才能真正进入癌变状态。
这就带来了一个令人困惑的现象,蝙蝠细胞在体外其实“很容易”癌变,那为什么它们在现实中几乎从不长肿瘤?
研究者指出,蝙蝠可能并没有依赖于细胞内那种铜墙铁壁式的防癌策略。也就是说,蝙蝠不是不让癌症细胞出现,而是一旦它们冒头,就迅速识别、果断清除。不强行阻止每一次癌变的发生,而是进化出了一整套更高效的应对方案。
抑癌双保险,高活性 p53与永续端粒酶
蝙蝠之所以能在轻易癌变的细胞背景下安然无恙,关键在于它们体内的某些机制始终处于高效运作状态。其中最引人注目的,是它们对p53这位抑癌明星的高度依赖。
p53被誉为“基因组的守护者”,在人体中,一旦细胞受到辐射或化学物质伤害,p53会立刻出动,要么修复 DNA,要么直接让问题细胞自我毁灭。正常情况下,人类体内只有一个p53 基因拷贝,而一些癌症(如乳腺癌、肺癌)正是因为p53功能丧失才得以快速发展。
而蝙蝠,尤其是小褐蝙蝠,竟然拥有两个完整的 p53 基因副本,并表现出远高于人类的转录活性。在实验中,即使在未受到辐射的状态下,这些蝙蝠细胞内的p53表达也维持在一个很高水平。
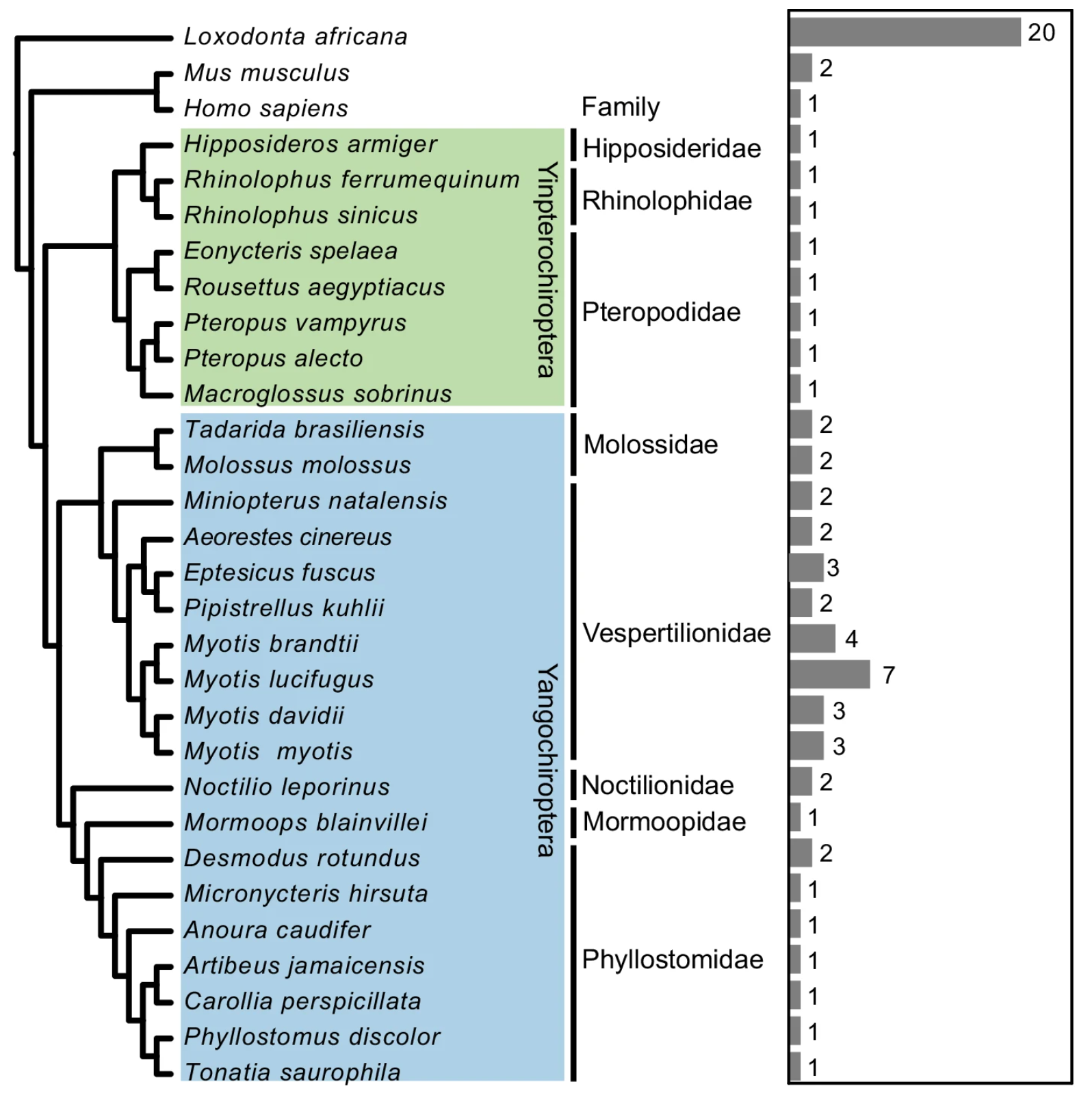
蝙蝠中TP53拷贝数统计(图片来源:参考文献[1])
但高活性 p53 本身也是把双刃剑,如果过于活跃,可能会导致正常细胞也被过度清除,反而损害组织功能。那么蝙蝠是如何避免这种“杀敌一千、自损八百”的风险的?答案是另一个关键因子——端粒酶(telomerase)。
一般来说,哺乳动物的体细胞分裂次数是有限的,因为每次复制都会损耗端粒,而端粒是染色体末端的帽子,一旦太短,细胞就会进入衰老甚至死亡。人类体内的端粒酶在多数体细胞中处于沉默状态,仅在干细胞或肿瘤中被激活。而蝙蝠的细胞——哪怕是普通的皮肤成纤维细胞——也持续表达活跃的端粒酶,能无限延长复制寿命。
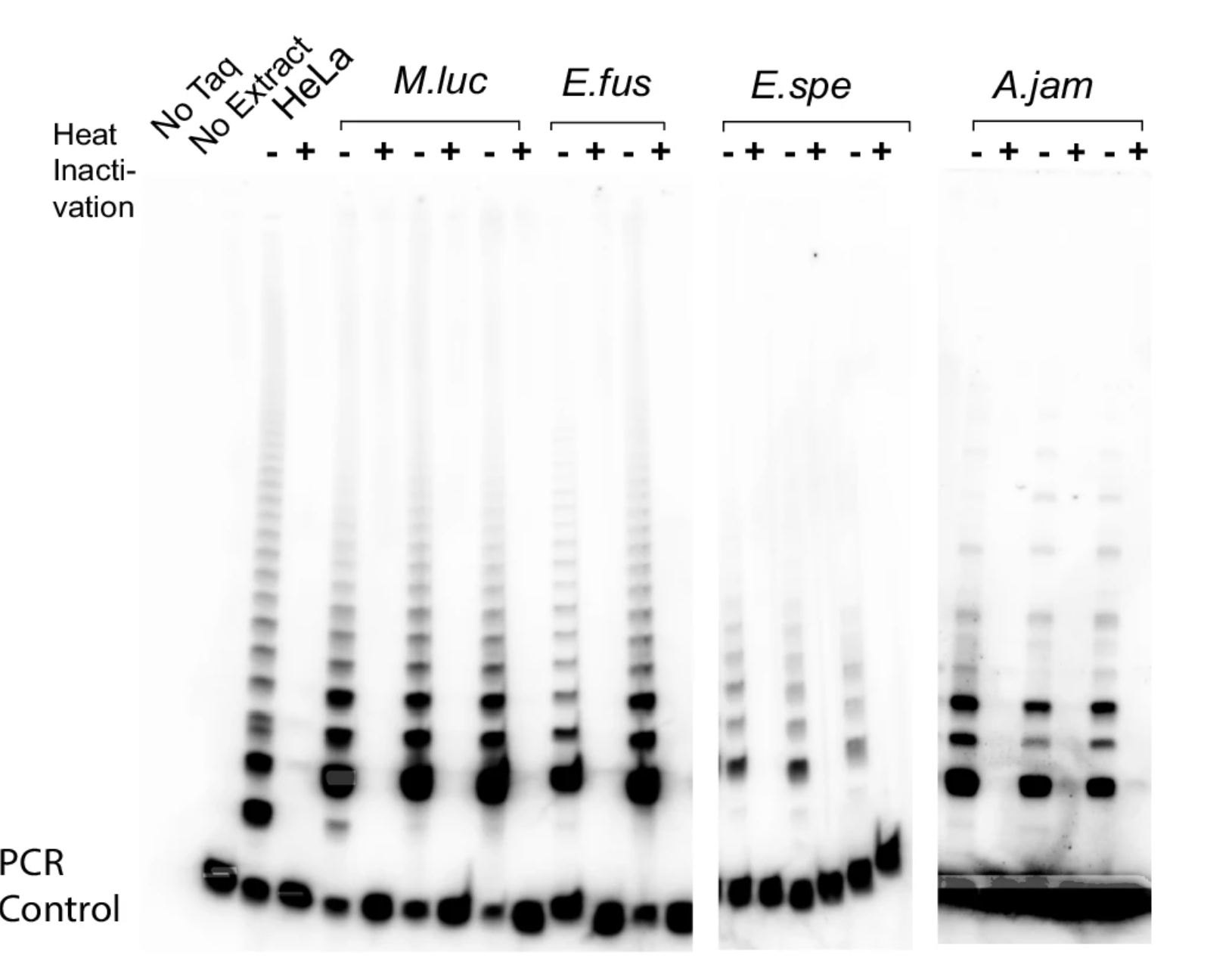
四个不同物种的蝙蝠翅膀成纤维细胞中的端粒酶活性(图片来源:参考文献[1])
这意味着,蝙蝠细胞既能持续再生,又能借助高活性的p53精准清除那些可能出错的细胞。再生与清除之间,达成了一种几乎理想的平衡。
免疫系统是蝙蝠的最后一道防线
蝙蝠还进化出一套高度警觉但极具克制性的免疫系统。这套机制不仅能迅速识别并清除异常细胞,还能有效避免自身组织因免疫过度而受损。
它们的免疫监视系统格外强大,自然杀伤细胞等免疫战士在体内超额配备,一旦发现潜在威胁便立即出击。同时,蝙蝠又能压制慢性炎症反应,包括干扰素通路常态化、炎症小体活性降低、老化细胞促炎因子减少,有效减少癌变诱因。
这种免疫策略并非专为抗癌而生,而是为应对飞行、高代谢和病毒压力而进化,意外地带来了防癌副作用。因此,蝙蝠或许不仅是病毒研究的关键动物,更是抗癌免疫研究的新模型。
总结
蝙蝠体内的细胞并不难被诱导癌变,却凭借高活性的 p53、永续的端粒酶与“克制而高效”的免疫巡逻,把潜在威胁关在了身体之外——既修复,又清除,还不被慢性炎症侵扰。对科学家来说,这意味着两条新思路,一是尝试安全提升人体 p53 活性或剂量,二是学习蝙蝠如何在绝不放过坏细胞的同时,又能避免自体炎症。或许,未来的抗癌药物与免疫疗法,就会从夜空中低飞掠过的蝙蝠汲取灵感。
参考文献:
[1] Athar, Fathima, et al. "Limited cell-autonomous anticancer mechanisms in long-lived bats." Nature Communications 16.1 (2025): 4125.
[2] Foley, Nicole M., et al. "Growing old, yet staying young: the role of telomeres in bats’ exceptional longevity." Science Advances 4.2 (2018): eaao0926.
[3] Wilkinson, Gerald S., and Danielle M. Adams. "Recurrent evolution of extreme longevity in bats." Biology letters 15.4 (2019): 20180860.
[4] Gomes, Nuno MV, et al. "Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination." Aging cell 10.5 (2011): 761-768.
[5] Gorbunova, Vera, Andrei Seluanov, and Brian K. Kennedy. "The world goes bats: living longer and tolerating viruses." Cell Metabolism 32.1 (2020): 31-43.
作者丨邵文亚博士 福建医科大学副教授;杨超博士
审核丨黄乘明 中国科学院动物研究所研究员 中国野生动物保护协会理事
图文简介
