科学家发现长寿新突破口,Klotho蛋白让小鼠延寿20%
我们能否延缓衰老?这或许是每个时代、每一代人都曾提出过的问题。从炼金术士苦苦寻找长生不老药,到当今实验室里研发的抗老抗衰分子筛选,人类对衰老的探索从未停止。
事实上,现代社会已经大幅度延长了人均寿命。过去一个世纪,凭借医学、营养和公共卫生的进步,越来越多的人活到了七八十岁。然而,活得更久并不总意味着活得更好。随着年龄增长,肌肉萎缩、骨质疏松、认知减退等常规老化现象往往接踵而至,严重影响了晚年的生活质量。
科学界也意识到,仅仅延长寿命还不够,健康寿命的延长,才是更具意义的目标。于是,一种被称为Klotho蛋白的分子悄然走红于衰老研究的舞台。它不仅与长寿相关,还可能具有增强认知、改善肌肉和骨骼健康的能力。

基因治疗使小鼠健康的长寿示意图(图片来源:作者使用AI生成)
那么,这种蛋白质真的能让身体年轻吗?一项刚刚发表的新研究通过基因治疗手段,在小鼠体内提升Klotho蛋白的水平,结果不仅延长了寿命,还显著改善了身体和大脑的功能。研究团队认为,这一成果为未来人类抗衰老治疗提供了全新的可能。
Klotho蛋白到底是什么?它有什么“抗老”本事?
Klotho,这个名字源于希腊神话中掌管生命丝线的命运三女神之一——克罗托(Clotho)。她象征着生命的开端,而Klotho蛋白,在生物学领域中似乎也确实与延长生命息息相关。
Klotho蛋白最早在1997年被发现于小鼠体内,当研究人员敲除该基因后,实验鼠迅速出现多种衰老相关症状,如骨质疏松、皮肤变薄、认知障碍等,寿命大幅缩短。而当研究人员过度表达Klotho时,寿命又显著延长。这一现象立即引发了科学界对Klotho功能的极大兴趣。
Klotho蛋白有三种主要形式,一种是膜结合型(m-KL),是最初由基因转录产生的全长蛋白,嵌于细胞膜上,尤其在肾脏和脑组织中较多。另一种是可溶型(p-KL),由膜型蛋白经酶切后释放入血液,可在全身发挥调节作用,还有一种是分泌型(s-KL),由另一种剪接形式产生,直接以可溶状态分泌入体液,拥有独立的C端结构,不依赖于酶剪切。
在功能层面,Klotho蛋白可谓是“抗老多面手”。在调节关键信号通路方面,它可影响胰岛素、胰岛素样生长因子-1等信号通路,这些都是与衰老、代谢和细胞增殖密切相关的核心机制。在抗氧化、抗炎反应反面,Klotho能够减少自由基产生、降低慢性炎症水平,缓解与年龄相关的细胞损伤。还能影响钙磷代谢,通过与成纤维生长因子23协同作用,调控肾脏对磷的重吸收,有助于维持骨骼稳态。除此之外,研究还发现,Klotho有助于维持神经元的结构与功能,促进神经再生,还能减轻阿尔茨海默症小鼠模型中的病理损伤。
相比于p-KL,s-KL更安全,不干扰矿物质代谢,更适合用作治疗手段。因此,在本次研究中,科学家们选择将s-KL作为“药物候选分子”,进行系统性测试,观察它在延缓衰老方面的真实效力。
“返老还童”的证据:s-KL在小鼠身上的惊人效果
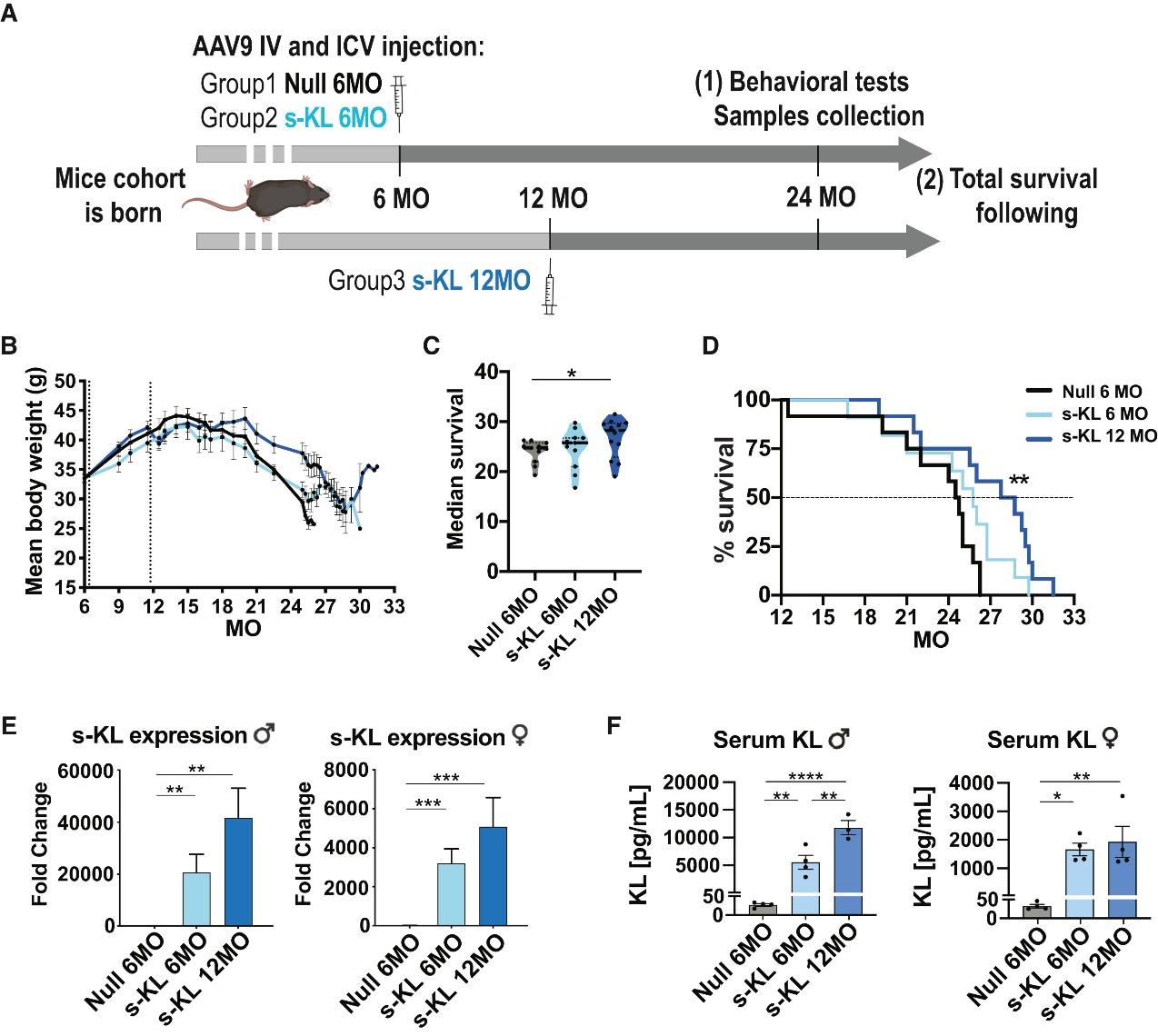
为了验证s-KL是否真的能延缓衰老、提升健康状态,研究团队设计了一项严谨的动物实验。他们采用一种常用于人类基因治疗研究的工具——AAV9病毒载体,将s-KL基因导入健康小鼠体内,并通过静脉注射和脑室注射的方式,实现全身和大脑同时高表达s-KL。处理分为两个时间点:一组在6月龄时接受治疗(相当于20-25岁的人类),另一组在12月龄时接受治疗(相当于38-47岁的人类),均持续观察至24月龄,约等于人类70岁。
定期接受治疗的小鼠(图片来源:参考文献[1])
结果令人惊讶,小鼠的寿命显著延长。其中,12月龄注射s-KL的小鼠群体寿命延长了近20%,中位生存期从24.6个月提高到28.3个月。这是首次在野生型非病态小鼠中,通过一次性基因介入治疗实现如此明确的延寿效果。
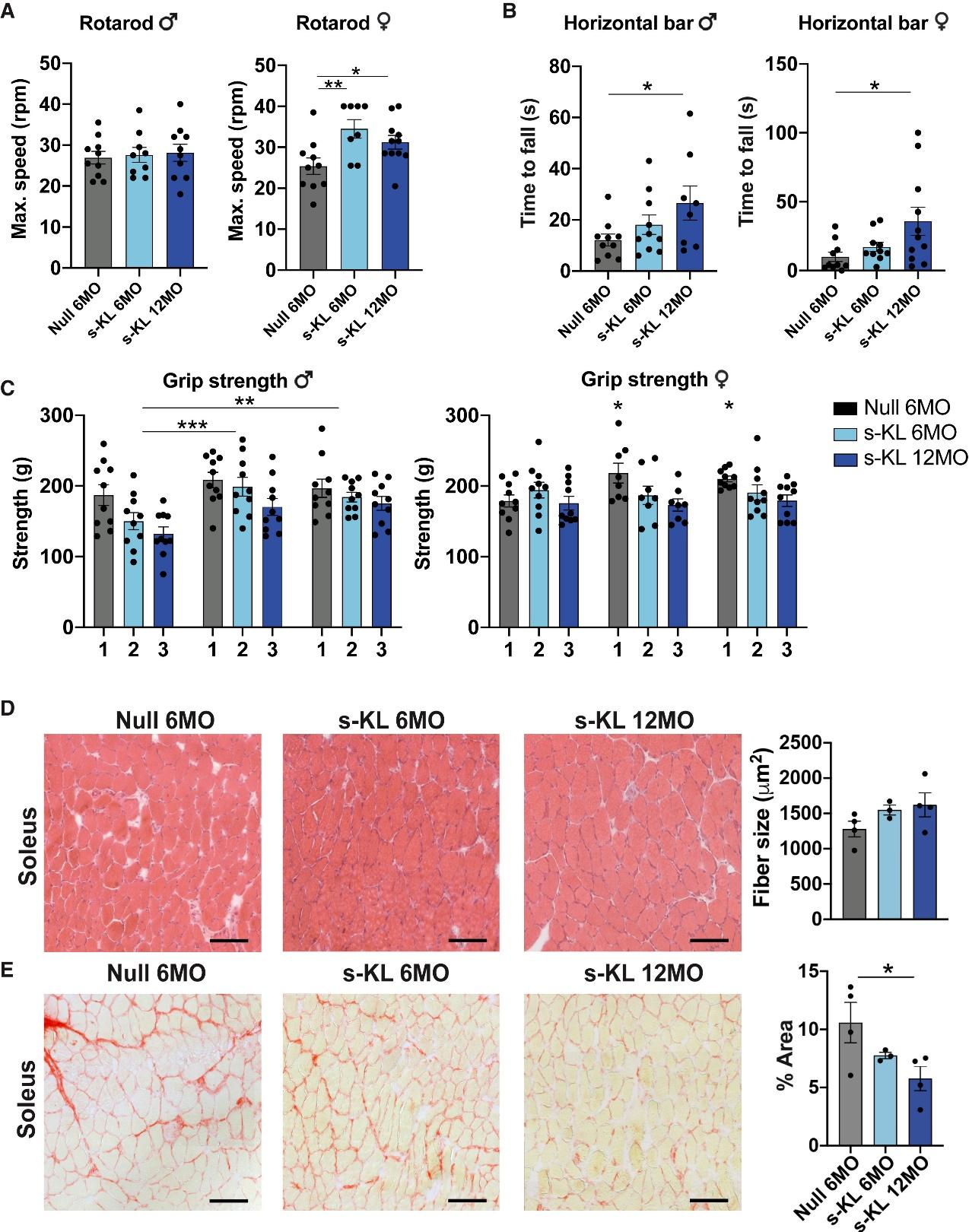
更重要的是,s-KL并非只是让小鼠“活得更久”,而是“活得更健康”。首先体现在肌肉功能的提升上。在一系列行为测试中,接受s-KL治疗的小鼠在悬杆、转棒和握力测试中的表现明显优于对照组,尤其是12月龄开始干预的个体,成绩更加突出。组织学观察显示,这些小鼠的肌肉纤维直径增大,结构更为紧致,且肌肉中的纤维化程度显著减轻。在肌肉移植实验中,s-KL处理组肌肉的再生能力也表现出优势,不仅有更多的肌源性干细胞(PAX7阳性)出现,而且增殖活跃的标志物Ki67与肌肉分化相关的MyoD表达均明显上升,说明其具备促进肌肉修复和再生的潜力。
接受治疗小鼠肌肉纤维对照图片(图片来源:参考文献[1])
其次,s-KL对于骨骼结构也有积极影响。微型CT扫描结果显示,雌性小鼠在接受s-KL治疗后,其骨小梁数量增多、厚度增加、间隙变小,骨架整体更为紧密。与此相符的是,一些与骨形成相关的基因如Runx2、Bglap和Col1a1的表达也被显著上调,提示s-KL可能通过调节骨代谢,发挥对骨质疏松的潜在预防作用。
在神经系统层面,s-KL也表现出保护效应。接受治疗的老年小鼠其海马区神经干细胞数量增加,未成熟神经元数量上升,且颗粒细胞层厚度也有提升,说明神经新生得到了部分恢复。同时,免疫组化结果表明,其脑部胶质细胞标志物如Iba1和GFAP表达水平上升,表明清除神经损伤的吞噬活性增强。而炎症因子IL-12水平下降、抗炎因子IL-10升高,说明s-KL不仅激活了免疫系统,也帮助维持了中枢神经系统的免疫稳态。
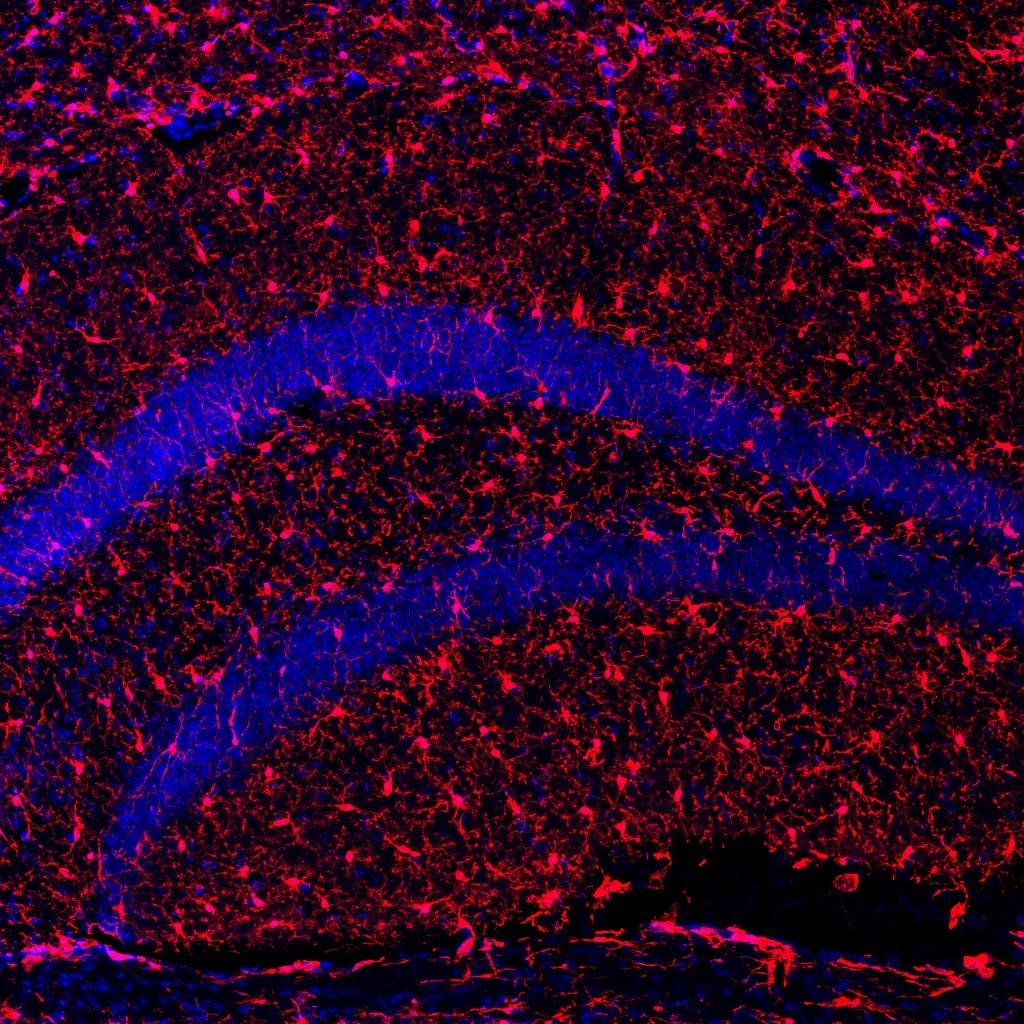
接受s-KL治疗的小鼠海马体小胶质细胞(大脑免疫系统的一部分,红色部分)的显微镜图像(图片来源:参考文献[1])
从分子层面来看,RNA测序分析进一步揭示了s-KL治疗的深层机制。与对照组相比,s-KL处理组老年小鼠的基因表达谱更接近年轻小鼠,特别是在能量代谢、抗氧化与神经炎症等通路上呈现出更年轻的特征。值得注意的是,神经修复、吞噬活性和免疫调节等相关基因表达被激活,而与线粒体功能障碍和慢性炎症相关的基因表达受到抑制,说明s-KL可能从根本上重塑了老年大脑的功能状态。简而言之,这项研究不仅证明了s-KL具有多器官的抗衰老能力,还为“系统性干预衰老过程”提供了一个全新角度,只要提升一种内源蛋白,就可能同步改善肌肉、骨骼、大脑三大系统,真正实现“延寿又延健”。
总结
科学家常说,衰老不是一种疾病,却是万病之源。而这项研究告诉我们,有些源头也许真的可以被调整。通过提升一种名叫Klotho的蛋白水平,小鼠不仅活得更久,还跑得更快、骨头更硬、脑子也更灵光。这不是科幻小说里的青春逆转,而是科学家一步一步用实验数据搭建的抗衰老拼图。虽然人类距离临床应用还有不少障碍,但我们至少知道了——延缓衰老,可能不再只是幻想。
参考文献:
[1] Roig-Soriano, Joan, et al. "Long-term effects of s-KL treatment in wild-type mice: Enhancing longevity, physical well-being, and neurological resilience." Molecular Therapy 33.4 (2025): 1449-1465.
[2]Kuro-o, M.. Klotho. Pflügers Archiv-European Journal of Physiology, 459.2 (2010): 333-343.
[3] Wang, Y., & Sun, Z.. Current understanding of klotho. Ageing research reviews, 8.1 (2009): 43-51.
[4] Xu, Y., & Sun, Z.. Molecular basis of Klotho: from gene to function in aging. Endocrine reviews, 36.2 (2015): 174-193.
[5] Kurosu, H., Yamamoto, M., Clark, J. D., Pastor, J. V., Nandi, A., Gurnani, P., ... & Kuro-o, M.. Suppression of aging in mice by the hormone Klotho. Science, 309.5742 (2005),:1829-1833.
作者丨Denovo科普团队(褚宏伟博士 湖南师范大学硕士生导师;杨超博士)
审核丨赵宝锋博士 辽宁生命科学学会
图文简介
