蛋白质设计也有“顾问”?这位 AI 比你更懂进化!
在生命科学的领域中,蛋白质始终扮演着核心角色。从催化化学反应的酶,到维持免疫功能的抗体,再到决定我们性状的调控因子均是蛋白质。因此,如何通过人工改造让蛋白质变得更好,早已成为生物医药、农业育种、生物制造等领域的共同追求。
传统蛋白质工程如同“盲盒式”试验,需要大量测试才能找到有效突变,既耗时又难以规模化。尽管如AlphaFold等人工智能带来新希望,但其高算力需求和模型复杂性限制了广泛应用。因此,亟需一种既懂结构、又懂进化,且低成本、高准确率的蛋白质设计新方法。
2025年7月,中国科学院的科研团队交出了一份令人惊喜的答卷,他们开发出一个名为基于人工智能的信息约束蛋白质工程(Al-informed Constraints for protein Engineering,AiCE )的智能蛋白质改造顾问。它不仅懂结构,还懂进化,以一种几乎反向思考的方式,提出高效而精准的蛋白质改造方案,正在悄然改变整个蛋白质工程的设计逻辑。

发表在《细胞》上的相关论文(图片来源:参考文献[1])
AiCE 是怎么懂结构、懂进化的?
我们常说蛋白质的结构决定功能,蛋白质就像一条被折叠成复杂三维结构的氨基酸项链,其折叠后的形状决定了它能不能精准对接特定的分子、完成生物反应中的任务。因此,科学家要想改造蛋白质,往往需要知道一件事,如果我把某一个氨基酸换掉,会不会毁了整条项链的形状?

蛋白质折叠示意图(图片来源:作者使用AI生成)
AiCE 的独特之处,在于它巧妙融合了两个维度的信息:结构与进化,并构建了一种全新的反向思维策略,称为反向折叠模型。
传统的蛋白质预测方法通常是给你一串氨基酸序列,猜猜它会折成什么结构。而反向折叠恰好相反,它从目标的三维结构出发,反过来推测哪一组氨基酸最可能折叠成这个样子。这个方向的好处在于,它天然适合用于蛋白质改造而不是预测,因为我们已经知道目标结构应该是怎样的,现在要找的是哪些突变可以保留甚至优化这个结构。
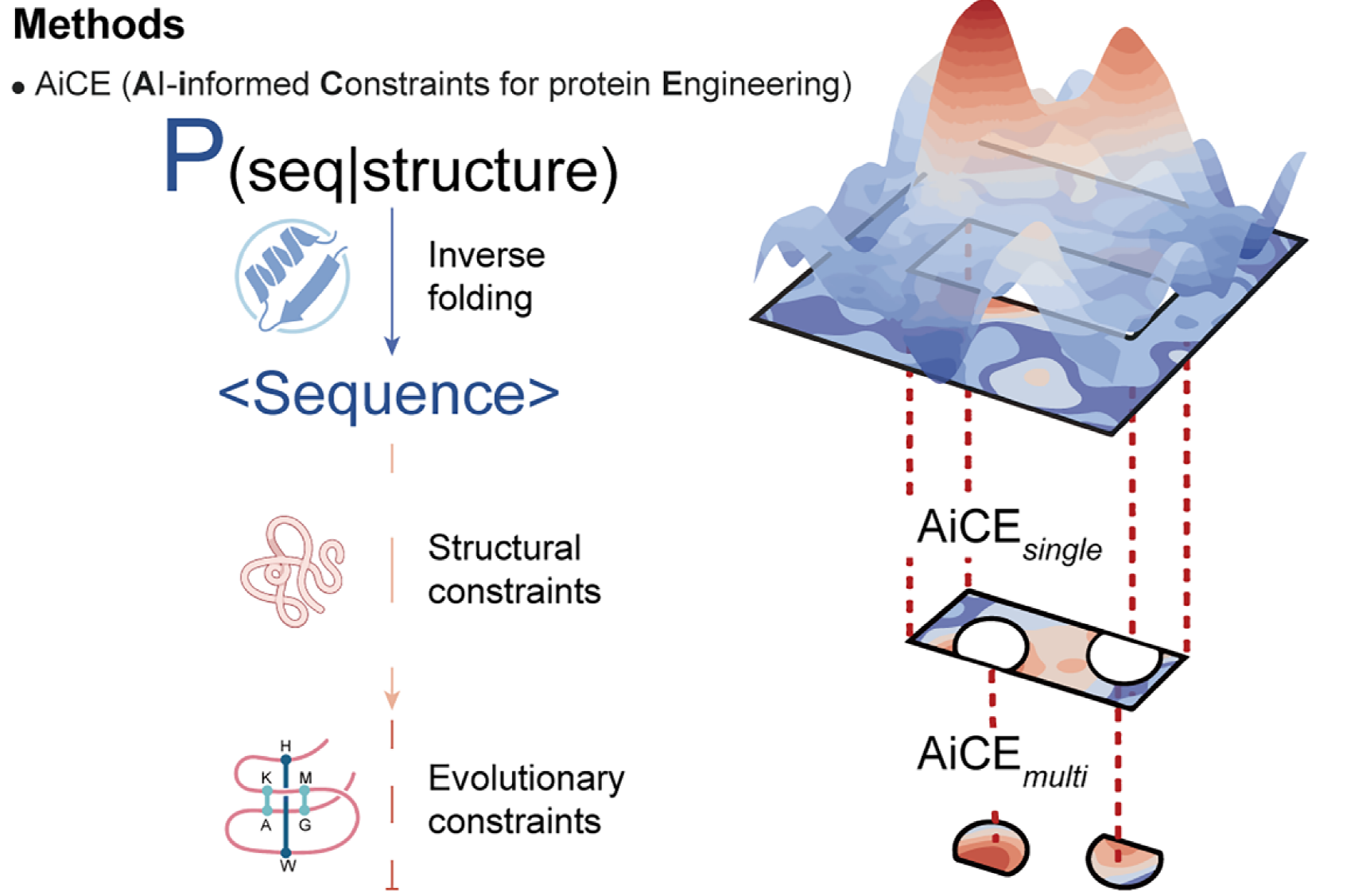
AiCE的方法及其两个模块AiCEsingle 与AiCEmulti(图片来源:参考文献[1])
AiCE 的第一个子模块叫 AiCEsingle,专门用于筛选只替换一个氨基酸的突变。它基于大量反向折叠模型的采样,辅以结构约束,比如某个位点如果埋在蛋白内部,适合用疏水性残基,如果在表面则可承受更多极性变体。实验结果显示,单靠引入结构约束,准确率就提高了 37%,远超大多数 AI 方法。
而在60个蛋白质功能突变的真实数据集中,AiCEsingle 的表现更是领先其他方法36%到90%,特别是在复杂蛋白和蛋白-核酸复合物的预测中表现出色。
蛋白质突变的组合并非简单叠加。一些突变单独存在可能是好的,但组合在一起却可能互相冲突,产生所谓的负向协同作用。
为了应对这一挑战,研究人员开发了第二个模块——AiCEmulti,它引入了进化耦合约束。该模块通过分析自然蛋白数据库中哪些氨基酸突变常一起出现,判断哪些组合是进化认可的,从而在预测多位点突变时更具可靠性。
简而言之,AiCE 就像一个拥有结构工程师和进化历史学家双重视角的蛋白质设计顾问。它既考虑这个蛋白怎么折才满足功能,也考虑怎么变才自然,帮助科学家做出更聪明、更稳妥的设计决策。
从编辑升级到功能进化
一个科学工具是否具有变革意义,最终还是要看它能解决什么问题。AiCE 不只是一个算法的进步,更是一种能推动蛋白质工程真正走向高效、低门槛、产业级应用的技术平台。在研究团队的验证中,AiCE 已成功将其理念应用于多种蛋白质的功能优化中,成果令人瞩目。
基因编辑是一项极其依赖蛋白质设计的前沿技术,尤其是碱基编辑器,它们要精确地将DNA上的一个碱基修订为另一个,关键就在于编辑酶的性能。
利用 AiCE,科研团队成功对多种编辑酶进行了高适应性突变设计,最终开发出多个性能大幅提升的新版本。这些编辑工具不仅在实验中展现出卓越性能,更为后续临床级基因治疗奠定了基础,真正体现了 AiCE 在精准医学领域的赋能能力。
除了基因编辑器,AiCE 还被成功用于优化多个结构和功能各异的蛋白质,包括:脱氨酶、核酸酶、核定位序列、逆转录酶。AiCE 的通用性在这些多样蛋白质中得到了验证,说明它不依赖于特定蛋白类型,而可广泛应用于各类结构复杂、功能精细的目标。
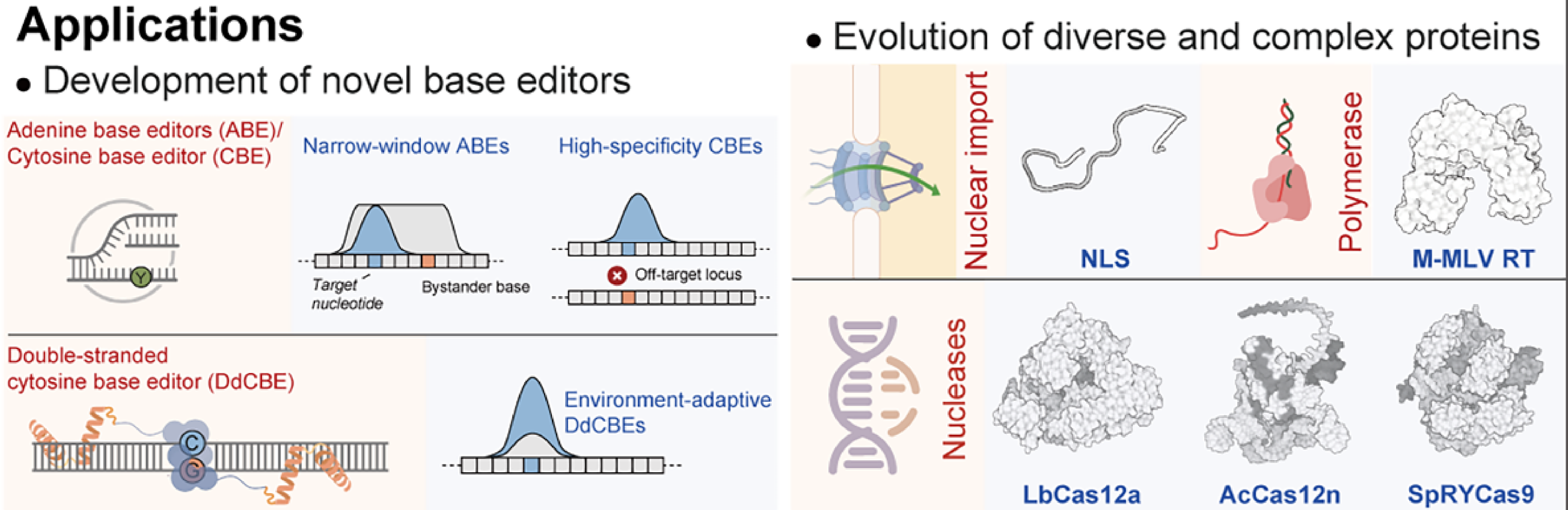
AiCE可用于基因编辑器和优化结构功能各异的蛋白质(图片来源:参考文献[1])
基于 AiCE 的蛋白质工程策略,展现出广阔的跨领域应用前景。在精准医学中,它可用于开发更安全、高效的蛋白药物和治疗工具;在农业育种上,能优化作物抗病性和营养合成能力;在工业中,可设计出耐受极端环境的高性能酶类;在基础科研领域,也有助于构建更强大的生物分子工具,服务于细胞工程、神经成像和合成生物学等研究。AiCE 正推动蛋白质设计从实验室走向实际应用。
简而言之,AiCE 不只是一个实验室里的概念验证,它正在成为一个可以被广泛复制、被大规模推广的蛋白质设计范式,让蛋白质改造不再是少数实验室的特权,而是未来各行各业可以轻松使用的生物技术能力。
总结
在蛋白质工程这条充满挑战的道路上,AiCE 的出现无疑是一剂强心针。它既不依赖庞大的AI训练,也无需海量计算资源,却能在结构和进化的双重常识指导下,做出比肩甚至超越主流AI模型的设计成果。这种低成本、高精度的策略,不仅提高了研究效率,更打开了蛋白质改造的普及化大门。未来,借助这样的工具,我们也许能更快地开发出对抗疾病的新疗法、提升农作物性能的关键蛋白,甚至实现分子层级的生物智造。技术在进步,关键是——它变得更容易被掌握了。
参考文献:
[1] Fei, Hongyuan, et al. "Advancing protein evolution with inverse folding models integrating structural and evolutionary constraints." Cell (2025): S0092-8674(25)00680-4.
[2] Arnold, Frances H. "Directed evolution: creating biocatalysts for the future." Chemical engineering science 51.23 (1996): 5091-5102.
作者丨褚宏伟博士 湖南师范大学硕士生导师;杨超 中国科普作家协会会员
审核丨赵宝锋博士 辽宁生命科学学会
图文简介
